Cøliaki

Cøliaki er en immunrespons i tynntarmens slimhinne der tarmtottene brytes ned og ødelegges av betennelse. Betennelsen skyldes en unormal og immunbetinget reaksjon på hvetegluten og liknende proteiner i rug og bygg.
Skrevet av Klinisk ernæringsfysiolog Kristin Melen.
Innholdsfortegnelse
- Hva er cøliaki?
- Sitter cøliaki i genene?
- Er cøliaki arvelig?
- Hvem får cøliaki?
- Hvilke symptomer gir cøliaki?
- Hvordan utredes cøliaki?
- Når bør gastroskopi utføres?
- Hvordan behandles cøliaki?
- Hvilke matvarer inneholder gluten?
- Hvordan bør pasienten følges opp etter innført diett?
Cøliaki er en immunrespons i tynntarmens slimhinne der tarmtottene brytes ned og ødelegges av betennelse. Normalt har slimhinnen i tynntarmen utallige små fingerlignende utløpere dekket av høyt spesialiserte epitelceller, som bidrar til at næringsstoffene i maten brytes ned og suges opp. Ved cøliaki skades disse cellene når den syke får i seg gluten. Betennelsen skyldes en unormal og immunbetinget reaksjon på hvetegluten og liknende proteiner i rug og bygg.
Gluten er lagringsproteiner som det spirende frøet benytter seg av, og består egentlig av to proteiner – gliadin og glutenin. Gliadin er stoffet som gjør at deigen hever seg skikkelig, men glutenin er stoffet som gjør at en deig binder seg. Vi vet at de som har cøliaki har intoleranse for gliadiner.
Bygg og rug inneholder lagringsproteiner som likner på dem i hvete, og en cøliaker reagerer ofte også på disse. I havre er lagringsproteinene mer ulike, og det ser ut til at flere med cøliaki tåler disse.
Patofysiologisk skjer forandringene ved cøliaki i de to første delene av tynntarmen, i tolvfingertarmen (duodenum) og den proksimale delen av tomtarmen (jejenum), lengst inn mot kroppens sentrum. Bindevevet i slimhinnen, lamina propria, infiltreres av makrofager og T-celler, som er rydde- og angrepsceller i kroppens immunforsvar. Vi ser også at T-celler kan gå inn i slimhinnens overflate, epitelet. Det dannes krypter eller innbuktninger i overflaten, og etter hvert atrofi, hvor tarmtottene svinner.
Vi har begynt å finne mer ut av genetikken bak cøliaki. Forskerne tror at en kombinasjon av flere gener disponerer for intoleransesykdommen, blant annet gener som koder for vevstypene HLA-DQ2 og HLA-DQ8. De aller fleste, så mye som mellom 90 og 95 prosent av de som har cøliaki i Norge, er bærer av vevstypen HLA-DQ2, mens de som mangler HLA-DQ2 har HLA-DQ8. Påvisning av de to vevstypene gjøres med en enkel blodprøve.
De aller fleste i befolkningen med HLA-DQ2 eller -DQ8 har imidlertid ikke utviklet sykdommen cøliaki. Så mye som 25 prosent av befolkningen HLA-DQ2, og bare et fåtall av disse har glutenintoleranse. Dette understreker at andre faktorer enn HLA-gener er viktige for sykdomsutviklingen.
Immunologisk kan reaksjonen på glutenproteinet forklares slik: Hos en cøliaker ser vi såkalte CD4-positive T-hjelpeceller i bindevevsdelen av tynntarmen, lamina propria. Disse hjelpecellene, som er en del av lymfocyttene og kroppens forsvarsceller, kjenner igjen glutenpeptider når de er bundet til HLA-DQ2 eller -DQ8 på antigenpresenterende celler. Antigenpresenterende celler er høyt spesialiserte celler som bearbeider og «presenterer» antigenet for T-lymfocyttene, slik at T-lymfocyttene kan reagere på antigenet og starte en immunreaksjon.
De glutenreaktive CD4-positive T-cellene i tarmen finnes kun hos cøliakere og ikke hos friske personer. I laboratoriet kan vi isolere og studere disse sykdomsspesifikke cellene fra tarmbiopsibiter vi får fra gastroskopiundersøkelsen.
Også enzymet vevstransglutaminase 2 (TG2) spiller en rolle i cøliaki. Enzymet ligger utenfor cellene i tynntarmens overflate, epitelet, og ved cøliaki danner immunforsvaret antistoffene IgA og IgG mot TG2 når kroppen blir eksponert for gluten. Antistoffene IgA og IgG har høy sykdomsspesifisitet, det vil si at de forsvinner ved glutenfri diett og kommer tilbake hvis cøliakeren igjen provoserer med gluten.
Årsaken til at immunforsvaret angriper tynntarmen er bare delvis klarlagt, men både miljø og arv kan spille inn. Vi har allerede sett at visse kombinasjoner av gener disponerer for sykdommen, og det viser seg at rundt 10 prosent av cøliakipasienter har nære slektninger som også har tilstanden. Hos eneggede tvillinger vil cøliaki i mellom 70 og 80 prosent av tilfellene opptre hos begge.
Når det gjelder miljø, ser det ut til at infeksjoner med ukjente bakterier eller virus kan spille en viktig rolle for å utløse sykdommen.
Èn av 100 får cøliaki. Sykdommen kan debutere i alle aldre – noen begynner å reagere som barn, andre først som voksne. Det er derfor viktig å være oppmerksom på at plager kan skyldes cøliaki også om pasienten er godt oppe i årene.
Cøliaki kan være asymptomatisk. Enkelte pasienter kan gå mange år uten nevneverdige symptomer, selv om undersøkelser av vevet i tynntarmen viser forandringer i slimhinnen.
De vanligste plagene er magesmerter, oppblåsthet, diaré, underernæring og malabsorpsjon, det vil si at tarmen har redusert evne til å ta opp næringsstoffer. Det kan igjen gi mineral- og vitaminmangel, vekttap eller manglende tilvekst, og ulike sekundære plager. Cøliakeren kan for eksempel utvikle anemi som følge av jern-, folsyre- eller vitamin B12-mangel, eller osteoporose som følge av kalsium- og vitamin D-mangel.
Tenk derfor cøliaki dersom pasienten er kortvokst, har jernmangel, er irritabel eller trøtt, har forsinket pubertet, skader på tannemaljen, hepatitt (leverbetennelse), artritt (leddbetennelser), forstoppelse eller osteoporose.
Det ser også ut til at cøliaki oftere forekommer hos personer som samtidig har er diabetes type 1, stoffskiftesykdommer, inflammatoriske tarmsykdommer som ulcerøs kolitt og Crohns syndrom, Downs syndrom, Turners syndrom, Williams syndrom og en hudsykdommen dermatitis herpetiformis.
Hos barn med diabetes 1 opptrer cøliaki ofte uten symptomer. Disse pasientene bør derfor testes for cøliaki fra tre års alder, etter å ha spist gluten i ett år. Serologisk testing bør gjentas hvert år, det vil si at blodserum undersøkes for immunologiske faktorer.
Hudsykdommen dermatitis herpetiformis kalles gjerne «hudens cøliaki», og kjennetegnes ved sterk kløe og et symmetriske utslett med små blemmer i grupper. Hos pasienter med denne hudsykdommen ser vi at mellom 80 og 90 prosent også har betennelsesforandringer i tynntarmen, og at glutenfri kost har gunstig virkning på eksemet.
Gastroskopi med biopsi av tynntarmen har lenge vært den medisinsk anerkjente metoden for å fastslå cøliaki, gjerne etter en periode der pasienten har provosert tarmen ved å spise glutenholdig mat.
Før gastroskopi undersøkes pasientens blod for ulike immunologiske markører. Cøliaki assosieres ofte med mangel på antistoffet IgA, og ved en slik mangel kan analyse av IgA-antistoffer mot transglutaminase (tTG), forkortet til IgA anti-tTG, være nyttig. Selv om nesten alle med cøliaki som har forhøyede verdier av IgA anti-tTG, er ikke testen 100 prosent pålitelig. IgA anti-tTG har en spesifitet på 95 prosent og en sensitivitet på mellom 80 og 90 prosent. Det betyr at en femtedel av pasienter med cøliaki kan få negativt utslag på glutenantistoffer ved serologi.
Andre markører som måles er deamiderte gliadinproteiner, IgG anti-deamidert gliadin og IgA anti-deamidert gliadin. Disse har lavere sensitivitet og lavere spesifisitet, men testen er mer sensitiv hos barn under to år.
Ulike kombinasjoner i prøvesvar indikerer følgende sannsynlighet for at pasienten har cøliaki:
IgA anti-tTG positiv og IgG anti-deamidert gliadin positiv: Meget høy sannsynlighet for aktiv cøliaki.
IgA anti-tTG positiv og IgG anti-deamidert gliadin negativ: Høy sannsynlighet for aktiv cøliaki.
IgA anti-tTG negativ, IgG anti-deamidert gliadin positiv: Høy sannsynlighet hos barn under tre år og hos pasienter med IgA-mangel. Utenom disse gruppene er betydningen usikker, men positiv gentest og høy serumkonsentrasjon styrker mistanke om aktiv cøliaki.
IgA anti-tTG negativ og IgG anti-deamidert gliadin negativ: Lav sannsynlighet for aktiv cøliaki.
Blodprøve kan også brukes for se om pasienten er genetisk disponert for cøliaki. Hvis ikke «cøliaki-genet» HLA-DQ2 eller HLA-DQ8 er til stede i blodet, kan sykdommen utelukkes. Pasienten bør imidlertid ikke ha utviklet cøliaki selv om testen er positiv.
Under ser du en samlet veiledning for diagnostisering av cøliaki, publisert av The European Society for Paediatric Gastroenterology Hepatology and Nutrition (ESPGHAN):
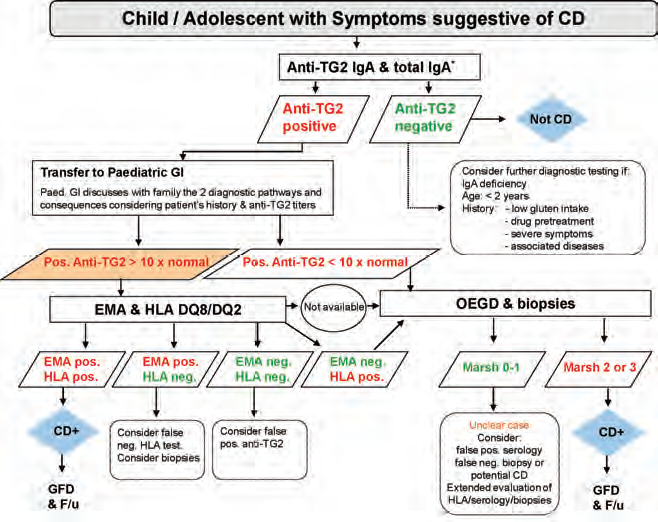
Ved gastroskopi føres et endoskop ned i spiserør, magesekk og tolvfingertarm for å se om tarmtottene er blitt skadet av betennelse. Det kan også tas en vevsprøve, en biopsi, i forbindelse med undersøkelsen.
Gastroskopien kan gi et falskt negativt resultat, på grunn av feiltolkning eller fordi sykdommen er på et såpass tidlig stadium at tarmtottene ikke er tilstrekkelig ødelagt. Undersøkelsen kan imidlertid ikke gi et falsk positivt svar.
Gastroskopi bør brukes ved positiv serologi, det vil si påvist IgA anti-tTG under 70 i blodet. Det bør også rekvireres ved negativ serologi, men ved klinisk mistanke og ved manglende symptomer, men tvil. Diabetikere uten symptomer, men med positiv serologi, bør også undersøkes med gastroskopi. Det samme bør barn under to år og ungdommer med non-compliance, som ikke følger legens medisinske råd.
Enkelte tilleggssymptomer kan også gi grunn til å henvise til gastroskopi. Dette kan være påvist helicobacter, en bakterie i magesekkens tynntarm som ofte forårsaker magesår. Det kan også være eosinofil øsofagitt, det vil si kronisk betennelse i spiserøret eller unormal laktaseaktivitet som ved laktoseintoleranse.
Den endelige diagnosen av cøliaki stilles ut fra serologiske analyser, gastroskopi og tarmbiopsi og en klinisk bedring etter at pasienten er satt på glutenfritt kosthold. Det er imidlertid viktig at pasienten ikke settes på glutenfri diett før diagnosen er satt.
Cøliaki behandles ved å unngå å spise matvarer med gluten. Når tarmen ikke blir eksponert for gluten, vil tarmtottene bygges opp igjen og cøliakeren blir fri for symptomer. Intoleransen overfor gluten er imidlertid kronisk, og den syke må unngå alt korn som inneholder gluten resten av livet.
Hvilke matvarer inneholder gluten?
Har paseinten cøliaki, må vedkommende unngå melprodukter fra kornsortene hvete, bygg og rug. Bare noen brødsmuler kan være nok til å utløse en reaksjon hos en cøliaker.
Vær også oppmerksom på at gluten skjuler seg i en mengde ferdigprodukter og halvfabrikata, så innholdsfortegnelsen må leses nøye. Se etter begreper som hvete, sammalt hvete, fullkornmel, durumhvete og hveteprotein, spelt og spelthvete, rug, rugmalt og bygg, grahammel, kli, semulegryn, kavring, dinkel, hvetesirup, malt, maltekstrakt og maltsirup, kruskablanding, kamut, tritikale og ølgjær.
Også couscous og pasta som nudler, makaroni og spagetti er basert på hvete.
Alternativer til glutenholdige kornvarer kan være bokhvete, hirse, ris, mais, quinoa, soya, sago, potet og ulike frø, tapioka, johannesbrødkjernemel, tragant, sorghum og teff. Det lages også en mengde glutenfrie produkter basert på hvetestivelse, der glutenproteinet er tatt bort. Hvetestivelse inneholder bare små rester av gluten, og tåles av de fleste med cøliaki. Både dagligvarer og helsekostforretninger har i dag et godt utvalg av glutenfritt mel og ferdigmikser, brød, rundstykker, pasta og annet.
De aller fleste med cøliaki kan også spise ren, spesialprodusert havre som ikke er forurenset av glutenholdige kornsorter. Glutenfri havre bør helst innføres i kostholdet etter seks måneder med glutenfri diett, når cøliakeren er symptomfri og har normale funn i blodserum.
Les mer om innholdet i glutenfrie melsorter og andre produkter her.
Hvordan bør pasienten følges opp etter innført diett?
Etter at pasienten er satt på glutenfri diett kan fallende serumkonsentrasjoner av anti-tTG IgA i blodet brukes til å bekrefte effekten av diettbehandlingen. Ved å provosere med gluten i kosten, vil blodprøver etter noen uker vise en stigning i verdiene.
Verdien av anti-deamidert gliadin IgG ved diettbehandling er mer usikker.
